薬機法とバーコード表示義務化
2019年12月に公布された改正薬機法(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律(令和元年法律第63号))に基づき、医療用医薬品、医療機器等へのバーコード表示が義務化されます。上記改正薬機法における、バーコード表示義務化にかかわる政策とその施行日は以下のとおりです。
- 添付文書の電子化 2021年8月1日(2年間の経過措置期間有り)
- バーコード表示の義務化 2022年12月1日
ヘルスケア製品へバーコード表示を行う事業者の方は、以下のページで改正薬機法対応に伴うバーコード表示の注意点をご確認ください。
バーコード表示の義務化
2022年12月1日より、製品の取り違え事故防止やトレーサビリティの確保、流通の効率化などを目的として、医療用医薬品、医療機器等へのバーコード表示が義務化されることとなります。
これに伴い、対象の製品には以下のGS1バーコードを用いて、GTINと合わせて有効期限、ロット番号などを表示することが必須です。
【関連する厚生労働省通知】
- 医療用医薬品を特定するための符号の容器への表示等について
- 医療用医薬品を特定するための符号の容器への表示等に関する質疑応答集(Q&A)について
- 医療機器、体外診断用医薬品等を特定するための符号の容器への表示等について
- 医療機器、体外診断用医薬品等を特定するための符号の容器への表示等に関する質疑応答集(Q&A)について
- 再生医療等製品を特定するための符号の容器への表示等について
- 再生医療等製品を特定するための符号の容器への表示等に関する質疑応答集(Q&A)について
◆医療用医薬品の場合

◆医療機器、体外診断用医薬品等の場合

※再生医療等製品については、上記いずれのバーコードも利用できることとされています。
※製品分類や包装単位により詳細規定がございます。対応の際は必ず上記通知をご確認ください。
添付文書電子化とGS1標準
2021年8月1日より施行されている添付文書の電子化においては、従来行われてきた紙の添付文書の同梱による情報提供に代えて、PMDA(独立行政法人医薬品医療機器総合機構)のウェブサイトで電子的に注意事項等情報の提供が行われることとなります。具体的には、各事業者でPMDAの安全性情報掲載システムに電子化された添付文書(電子添文)などの製品情報を登録し、製品を使用する医療機関等は、各事業者によりPMDAに登録された情報を参照する という方法へ、2023年7月31日までに移行することとなります。
医療機関等がPMDAに登録された製品情報を閲覧する手段として、GS1バーコード(注)が利用できることとなっています。各事業者がPMDAへの登録時に、製品に表示されたGS1バーコード上のGTINと電子添文とを紐づけて登録することが必要とされており、これによりアプリなどを用いて製品の容器または被包等に表示されたGS1バーコードを読み取ると、バーコード上のGTINをもとに最新の電子添文にアクセスすることが可能です。電子添文以外にも、審査報告書などの関連文書もGS1バーコードを用いて閲覧することが可能です。
(注) 原則として、トレーサビリティ等の目的でも表示が義務化されているGS1バーコードが、電子添文閲覧用にもそのまま利用されています。
【関連する厚生労働省通知】
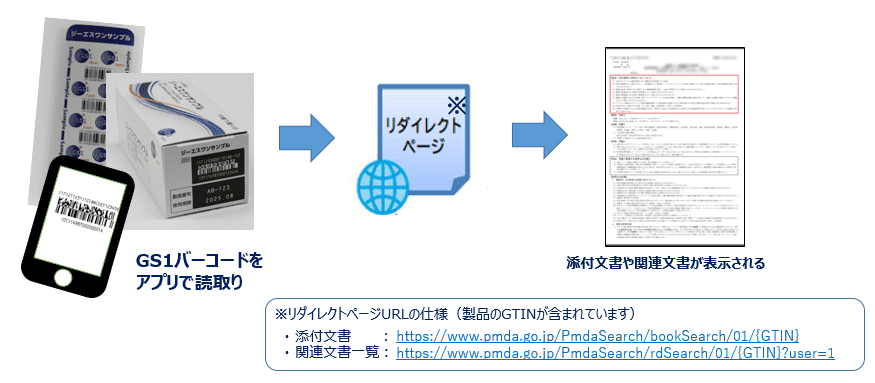
【参考】PMDAウェブサイト:https://www.pmda.go.jp/safety/info-services/0003.html
添付文書閲覧アプリ「添文ナビ」

日本製薬団体連合会、医療機器産業連合会、GS1 Japanが共同で開発した医療従事者用のアプリケーション(アプリ)で、医薬品、医療機器等の包装上のGS1バーコードを読み取り、PMDAのホームページの添付文書情報等を閲覧できるものです。
「添文ナビ」の詳細およびインストール方法については下記ページをご参照ください。
※本ページでご案内している内容は、2022年10月1日時点で公表されている情報をもとに作成しています。